近日,《(CSCO)宮頸癌診療指南2024版》[1]更新發布,由石藥創新自主研發的恩朗蘇拜單抗注射液(商品名:恩舒幸)獲得指南的Ⅱ級推薦。此前,恩朗蘇拜單抗已獲得《中國婦科腫瘤臨床實踐指南2024版》[2]與《子宮頸癌免疫檢查點抑制劑臨床應用指南2024版》[3]的2A類雙推薦。再次入選《(CSCO)宮頸癌診療指南2024版》,為恩朗蘇拜單抗的臨床應用提供高效科學的臨床指導。上市首年,恩朗蘇拜單抗即獲三大權威指南推薦,充分體現了產品在婦瘤領域的治療地位。
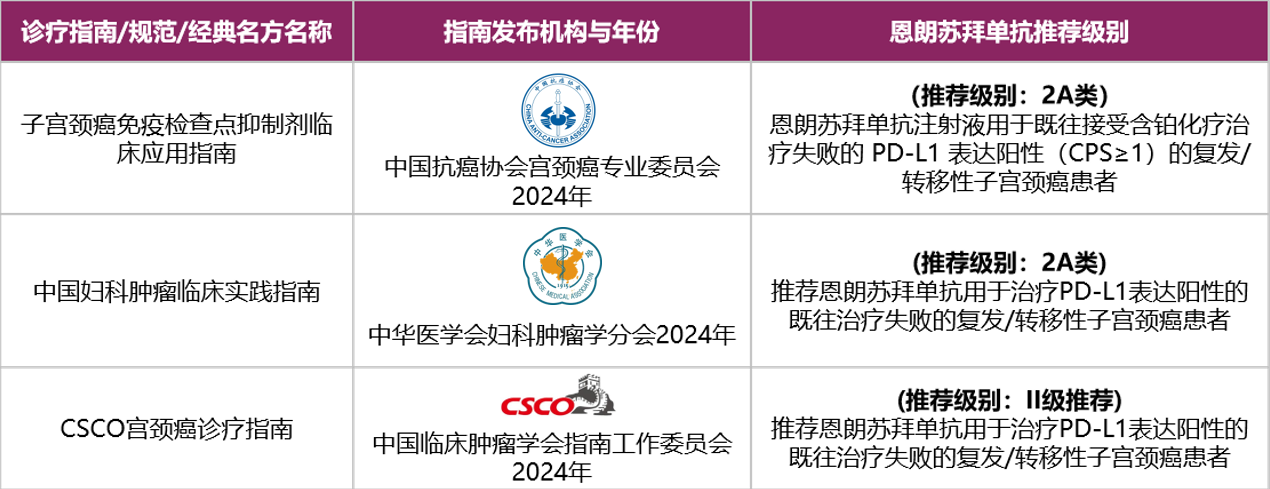
近日,《(CSCO)宮頸癌診療指南2024版》[1]更新發布,由石藥創新自主研發的恩朗蘇拜單抗注射液(商品名:恩舒幸)獲得指南的Ⅱ級推薦。此前,恩朗蘇拜單抗已獲得《中國婦科腫瘤臨床實踐指南2024版》[2]與《子宮頸癌免疫檢查點抑制劑臨床應用指南2024版》[3]的2A類雙推薦。再次入選《(CSCO)宮頸癌診療指南2024版》,為恩朗蘇拜單抗的臨床應用提供高效科學的臨床指導。上市首年,恩朗蘇拜單抗即獲三大權威指南推薦,充分體現了產品在婦瘤領域的治療地位。

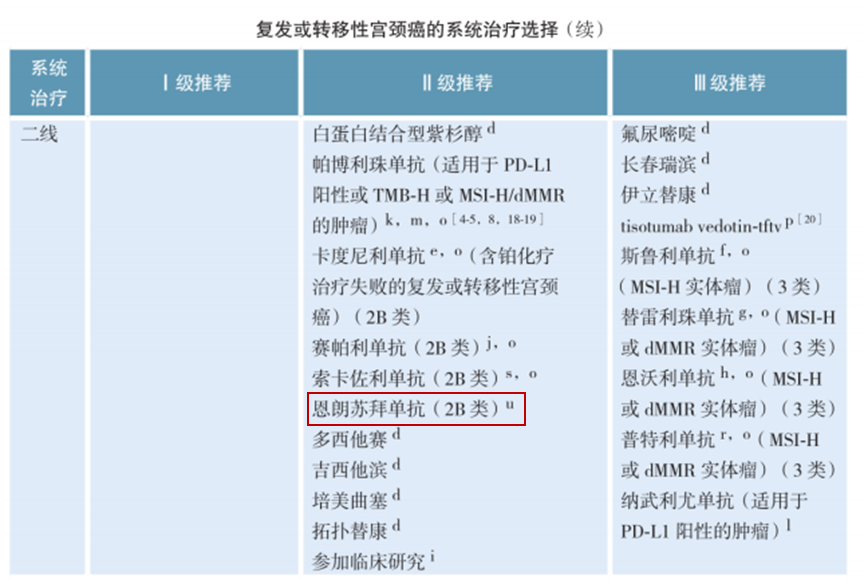

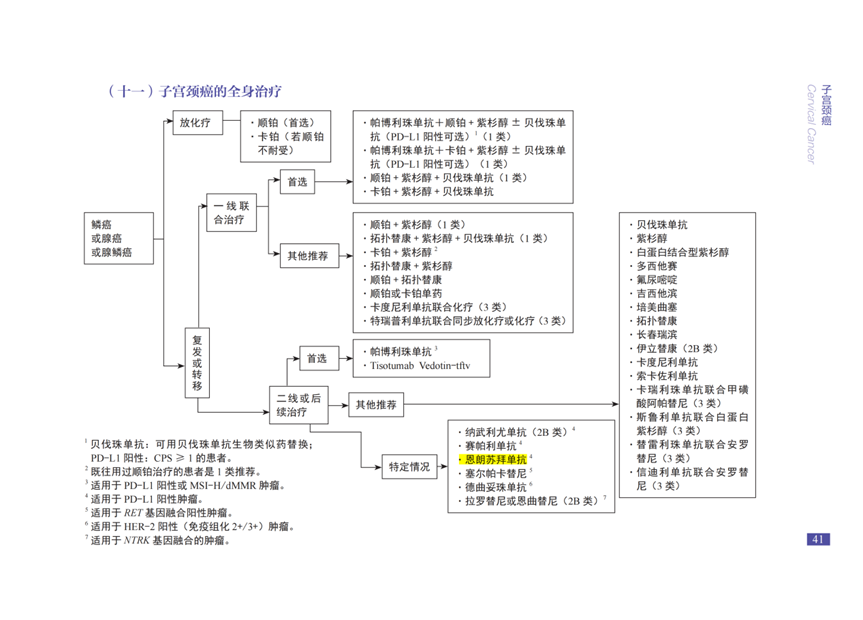

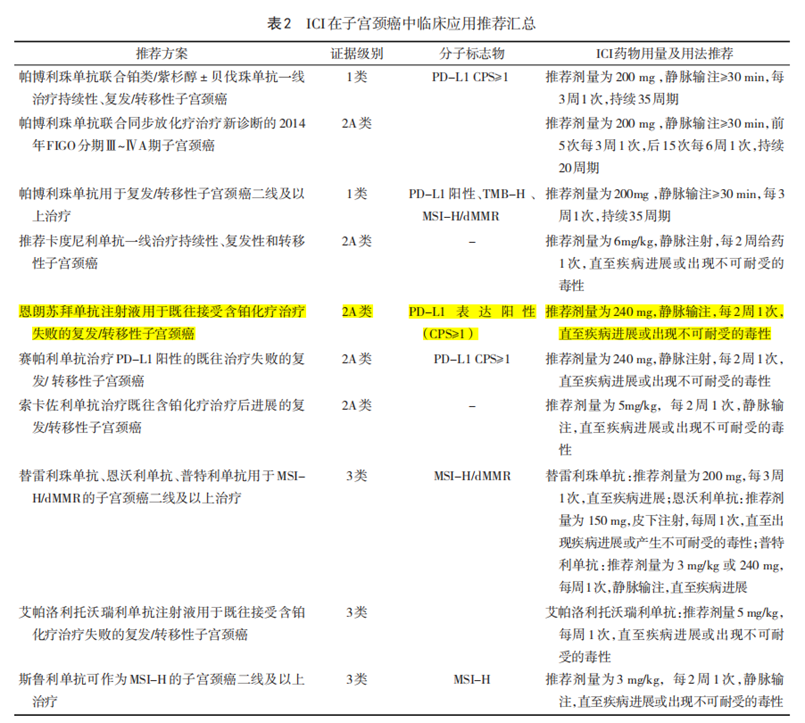
恩朗蘇拜單抗注射液是治療用生物制品1類,擁有發明專利和完全自主知識產權。恩朗蘇拜單抗Ⅱ期研究結果在2024
ASCO年會發布,基于其積極研究結果于2024年6月獲NMPA批準上市,用于既往接受含鉑化療治療失敗的
PD-L1表達陽性(CPS≥1)的復發或轉移性宮頸癌。恩朗蘇拜單抗全新CDR序列具有更強阻斷活性,更高免疫應答水平,發揮快起效、強生存、強控制、強緩解、強安全等五大優勢。四強一快,領航金標,期待恩朗蘇拜單抗為更多患者帶來獲益。
快起效:恩朗蘇拜單抗起效時間僅1.4個月[4]
強生存:恩朗蘇拜單抗≥二線單藥治療復發或轉移性宮頸癌,中位OS長達21.26個月[5]
強控制:恩朗蘇拜單抗≥二線單藥治療復發或轉移性宮頸癌,疾病控制率為54.2%[6]
強緩解:≥二線單藥治療ORR 29%[5],一線聯合治療ORR 71%[7]
強安全:3級免疫相關不良事件發生率僅為7.5%,無4級免疫相關不良反應發生[6]
恩朗蘇拜單抗獲中國三大權威指南推薦,是對石藥集團研發創新能力的肯定,集團將會持續推動婦瘤領域臨床研究,隨著臨床研究結果陸續發布,將擴大藥物適應癥,獲益人群逐漸擴大,更好發揮免疫新藥臨床價值,為越來越多患者帶來希望之光,為全球醫療衛生事業的發展貢獻自己的力量。
參考來源:
[1]宮頸癌診療指南2024版
[2]中國婦科腫瘤臨床實踐指南2024版.
[3]中國實用婦科與產科雜志2024年7月第40卷第7期.
[4]Cancer Communications. 2024;1-5.
[5] SG001恩朗蘇拜單抗Ⅱ期臨床研究.
[6] 2024ASCO壁報SG001恩朗蘇拜單抗Ⅱ期臨床研究.
[7] SG001恩朗蘇拜單抗Ⅲ期臨床研究.
相關新聞
-
- 2025/06/10
- 石藥創新SYS6040抗體偶聯藥物獲得美國臨床試驗批準
-
- 2025/06/04
- 石藥中諾泰州公司獲評“江蘇省先進級智能工廠”
-
- 2025/05/20
- 石藥創新SYS6010(CPO301)抗體偶聯藥物獲得美國FDA快速通道資格
-
- 2025/04/17
- 石藥創新烏司奴單抗3期臨床研究結果在皮膚科頂刊發表
